Das molekulare Kontrollzentrum unserer Proteinfabriken
Konstanzer und Züricher Forschende entschlüsseln einen biochemischen Mechanismus, der dafür sorgt, dass neuentstehende Proteine beim Verlassen der zelleigenen Proteinfabriken korrekt weiterverarbeitet werden. Damit wird ein seit langem bestehendes Rätsel der Proteinsortierung gelöst.
In den Proteinfabriken unserer Zellen, den Ribosomen, werden nach Vorgabe genetischer Baupläne einzelne Aminosäuren zu langen Aminosäure-Ketten, den Proteinen, zusammengesetzt. Dabei beginnt jedes neuentstehende Protein zunächst mit der Aminosäure Methionin. Diese wird häufig noch während der laufenden Proteinsynthese wieder abgespalten, sobald die wachsende Aminosäure-Kette die Proteinfabrik durch den sogenannten „ribosomalen Tunnel“ verlässt. Die Abspaltung des Methionins ist in diesen Fällen essenziell, um die spätere Funktion der betroffenen Proteine in der Zelle zu gewährleisten.
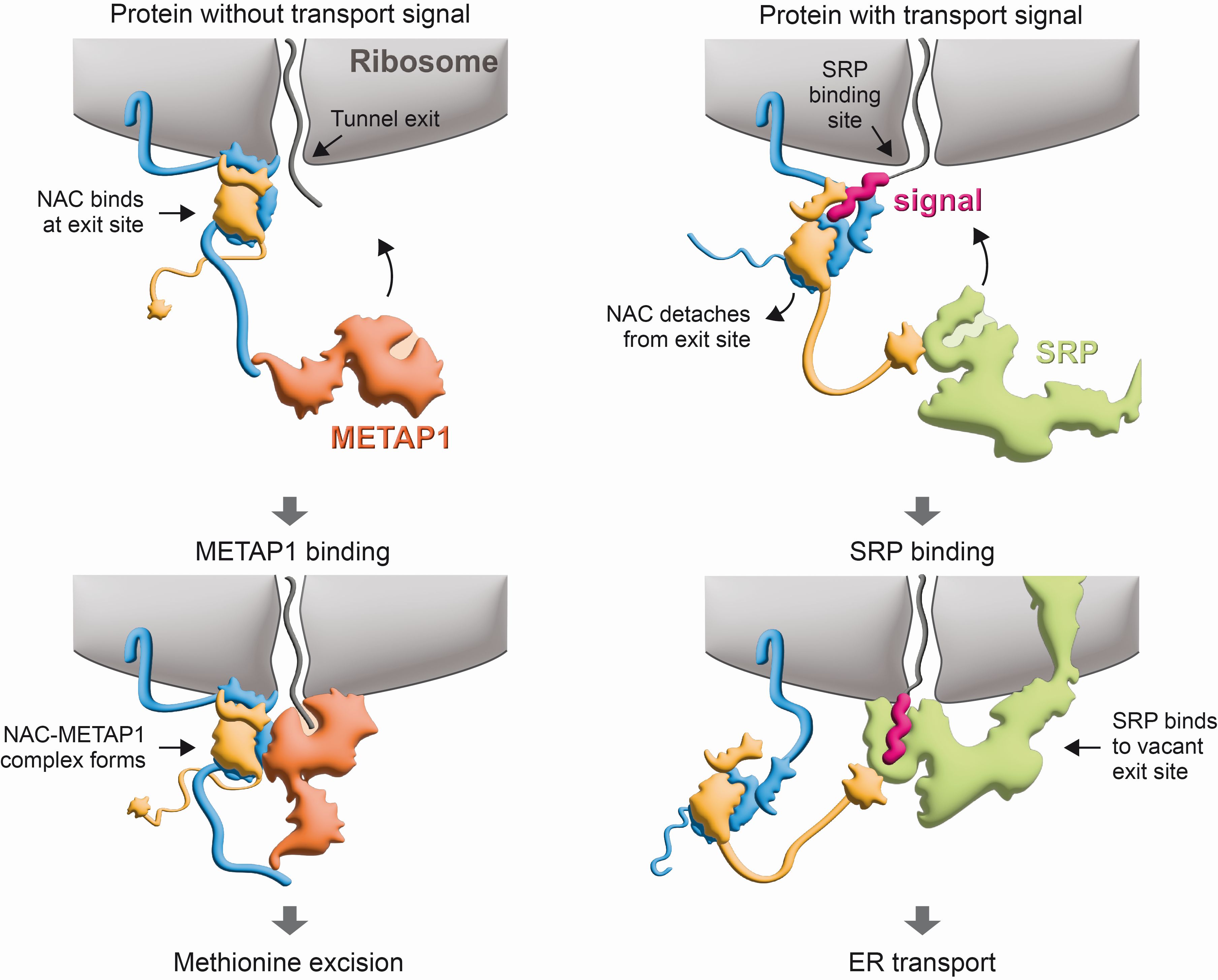
Die Enzyme, die diese Abspaltung bewirken, sind bereits bekannt. Sie werden nach ihrer Funktion als Methionin-Aminopeptidasen (METAPs) bezeichnet. Wie METAPs in räumlichen Kontakt mit den Proteinfabriken kommen, um genau im richtigen Moment und am richtigen Ort die Abspaltung des Methionins von bestimmten Proteinen zu bewirken, war bisher unklar. Die Konstanzer BiologInnen Elke Deuerling und Martin Gamerdinger und ihr Team brachten nun gemeinsam mit Nenad Ban und seinen MitarbeiterInnen von der ETH Zürich Licht ins Dunkel. Die in Science veröffentlichten Ergebnisse zeigen: Der Zugang von METAPs zu den Proteinfabriken wird durch einen „ribosomalen Torwächter“ namens NAC (kurz für „nascent polypeptide-associated complex“) kontrolliert.
Umfangreichere Funktion als bisher bekannt
Erst im vergangenen Jahr (2022) konnte das Team um Deuerling und Gamerdinger aufklären, dass NAC am ribosomalen Tunnel eine wichtige Sortierfunktion übernimmt: „Wir konnten damals zeigen, dass sich NAC wie ein Torwächter vor den Tunnelausgang setzt. Dort vermittelt es dann den Transport von Proteinen zum endoplasmatischen Retikulum (ER) – das ist ein Membrannetzwerk im Inneren der Zelle – indem es Protein und Transportmolekül (SRP) gezielt zusammenbringt“, fasst Deuerling die vorherigen Studienergebnisse zusammen. In ihrer neuen Studie zeigen die Forschenden nun, dass die Sortierfunktion des Torwächters umfangreicher und noch bedeutsamer ist als bisher bekannt und dass NAC auch für die korrekte Methionin-Abspaltung von neuentstehenden Proteinen sorgt.
Bei Proteinen, die zum ER transportiert werden, ist die erste Aminosäure Methionin ein Teil eines Transportsignals. „Eine Methionin-Abspaltung bei diesen Proteinen würde das Signal zerstören und damit den Transport in das Membrannetzwerk der Zelle verhindern, was unweigerlich zum Zelltod führen würde“, erklärt Gamerdinger. Wie verhindert wird, dass diese Transportsignale von METAPs zerstört werden, war ein großes wissenschaftliches Rätsel, welches die Konstanzer und Züricher WissenschaftlerInnen nun lösten: Der Torwächter NAC bildet mit dem Ribosom am Ausgang des ribosomalen Tunnels einen Komplex mit METAP1. Nur innerhalb dieses Komplexes kann das Enzym bei neuentstehenden Proteinen die Abspaltung von Methionin bewirken.
Die Lage ändert sich, sobald ein Protein mit Transportsignal den ribosomalen Tunnel verlässt. Wechselwirkungen zwischen der Signalsequenz des Proteins und NAC sorgen dann dafür, dass der Torwächter die eigene Position am ribosomalen Tunnel verändert. Dadurch verliert METAP1 seine Bindung zu NAC und damit die Fähigkeit, Methionin abzuspalten. Durch die Positionsänderung des Torwächters wird stattdessen eine neue Bindungsstelle für das Transportmolekül SRP zugänglich. „Dieser Mechanismus bewirkt, dass Proteine ohne Signalsequenzen durch Methionin-Abspaltung gezielt modifiziert werden können. Solche, die zum endoplasmatischen Retikulum transportiert werden, bleiben dagegen von METAP1 unangetastet“, erklärt Gamerdinger.
Der Torwächter als Vermittlungs-Allrounder?
Die Forschenden vermuten, dass NAC noch weitere, ähnliche Vermittlungsfunktionen am ribosomalen Tunnel haben könnte und damit die Rolle eines allgemeinen molekularen Kontrollzentrums einnimmt. „Es gibt eine ganze Reihe von Enzymen und Transportmolekülen, die wie METAP1 bzw. SRP bereits während der Proteinsynthese mit den entstehenden Proteinen interagieren. Zukünftige Studien werden daher zeigen müssen, ob NAC auch bei der Regulierung weiterer Vorgänge, die für die biologische Funktion unserer Zellen lebenswichtig sind, eine Rolle spielt“, so Deuerling.
Faktenübersicht:
- Originalpublikation: M. Gamerdinger et al. (2023) NAC controls cotranslational N-terminal methionine excision in eukaryotes. Science; doi: 10.1126/science.adg3297
- Internationales Forschungsteam aus Konstanz und Zürich erweitert bestehendes Modell zum Funktionsmechanismus des „ribosomalen Torwächters“ NAC
- Förderung: Deutsche Forschungsgemeinschaft (DFG), Schweizerischer Nationalfonds (SNF), Europäischer Forschungsrat (ERC)

